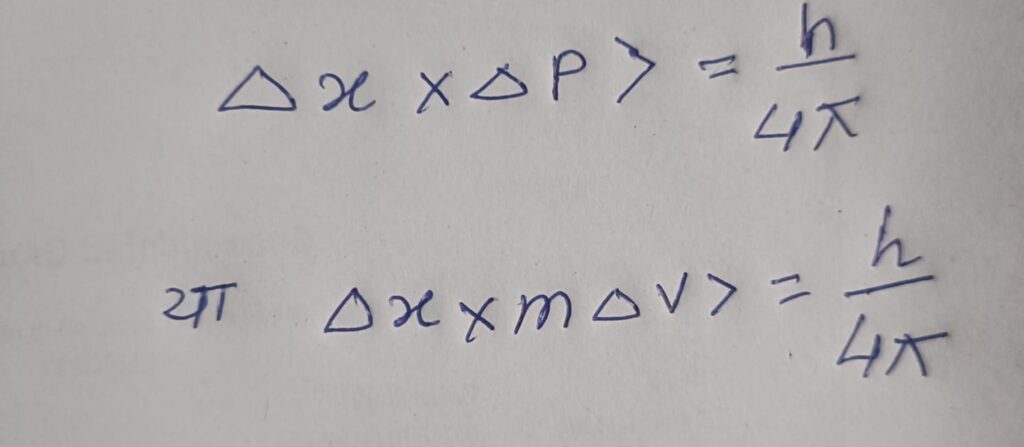Class 12 Nios Board Chemistry Chapter 2
Class 12 Nios Board Chemistry Chapter 2n परमाणु की संरचना
परमाणु संस्चना को समझाइए ।
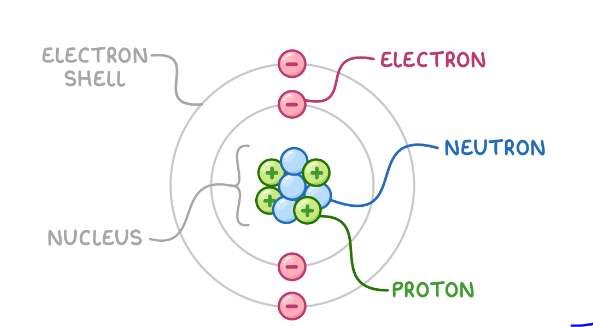
उत्तर -किसी तत्व की परमाणु संस्चना उसके नामिक तथा एलेक्ट्रोनो की संख्या उसके चारो पाये जाने वाले इलेक्ट्रानो की संख्या को बताती हैं | मुख्य रूप से पदार्थ की परमाणु सरचना, प्रोटोन, इलेक्ट्रान व न्यूट्रॉन से मिलकर बनी होती हैं | प्रोटोन और न्यूट्रॉन परमाणु के नाभिक का निर्माण करती हैं | किसी तत्व को परमाणु संख्यो उसके नाभिक मे प्रोट्रानो की कुल संख्या को बताती है।
परमाणु मॉडल :-
18 वी एव 19 वी शताब्दी मे अनेक वैज्ञानिक ने परमाणु मॉडलों की सहायता से परमाणु की संरचना इन मॉडलों में से प्रत्येक को समझने का प्रयास किया। इनके अपने गुण और अवगुण थे, और आधुनिक परमाणु क मोडल के विकाश के लिए महत्वपूर्ण थे। इसका योगदान जान डाल्टन, जे. जे. थॉमसन अर्नेस्ट रदरफोर्ड और नील्स बोहर जैसे वैज्ञानिक को जाता हैं |
डाल्टन का परमाणु सिद्धान्त सम्झाइए
उत्तर -डाल्टन एक अङ्ग्रेजी राष्ट्रायनज्ञ थे। डाल्टन ने सुझाव विया कि सभी पदार्थ परमाणुओ से मिलकर बने होते हैं , जो अविभाज्य और अविनाशी है। उन्होंने यह भी कहा कि एक तत्व के सभी परमाणु बिल्कुल समान होते हैं। लेकिन विभिन्न तत्वो के परमाणु आकार द्रव्यमान मे भिन्न होते है।
‘ डाल्टन के परमाणु सिद्धान्त के अनुसार रासायनिक अभि क्रियाओ में उत्पाद बनाने के परमाणुओ की पुर्नव्यवस्था शामिल होती है। डाल्टन द्वारा प्रस्तावित पोस्स्टुलेट्स के अनुसार, परमाणु किसी भी होंने वाली रासायनिक क्रिया मे भाग ले सकता हैं |
डाल्टन सिद्वान्त के महत्वपूर्ण आभगृहीत
१. हर पदार्थ परमाणु परमाणुओं से बना होता है। परमाणु अविभाज्य है।
२. विशिष्ट तत्वों में केवल एक प्रकार के परमाणु होते हैं।
३. प्रत्येक परमाणु का अपना स्थिर द्रव्यमान होता है | जो एक तत्व से दूसरे तत्व से भिन्न होता है।
४. रासायनिक प्रतिक्रियों के दौरान परमाणु पुर्नव्यवस्था से गुजरते है।
परमाणुओं को न तो बनाया जा सकता है, ओर ही नष्ट किया जा सकता है, बल्कि एक रूप से दूसरे रूप में बदला जा सकता है।
डाल्टन के परमाणु सिद्धान्त के दोष-
1. . डाल्टन समस्थानिको के अस्तित्व की व्याख्या करने मे असमर्थ था।
2. डाल्टन् परमाणु की सस्चना के विषय में कुछ भी ठीक से नहीं बता पाया।
3. वैज्ञानिको ने परमाणु के अन्दर ऐसे कणो की खोज की जो यह साबित करते है कि परमाणु विभाज्य है।
1. टामसन परमाणु मॉडल
अंग्रेजी रासायनज्ञ सर जोसेफ जॉन थॉमसन ने 1900 की शुरुआत में परमाणु संरचना का वर्णन करने वाला अपना माडल पेश किया। बाद में उन्हें “इलेक्ट्रान की खोज के लिए नोबेल पुरस्कार से सम्मानित किया गया।
NOTE- इनका काम कैथोड रे प्रयोग नामक प्रयोग पर आधारित है।
पश्न- रदरफोर्ड परमाणु सिद्धान्त को समझाइसे
उत्तर-जे जे थामसन के एक प्रयोग को रदरफोर्ट ने न्यूक्लियस नामक एक अन्य उप-परमाणु कण की खोज के साथ परमाणु संरचना को संशोधित किया । उनका परमाणु मॉडल अल्फा किरण प्रकीर्णन प्रयोग पर आधारित था।
अल्फा रे स्कैटरिंग प्रयोग –
निर्माण : इसने 1000 परमाणुओ की मोटी एक बहुत पतली सोने की पन्नी ली।अल्फा किरणे (दोगुना आवेशित महै²) सोने की पत्नी पर बमबारी करने के लिए बनाई गई थी
Zns स्क्रीन को गोल्ड फाईल के पीछे रखा गया।अधिकाश किरणे पन्नी पर चमकीले धब्बे बना कर निकलती हैं, व कुछ हुए किरणे पन्नी से टकराकर बाद मे परावर्तित होती हैं| 1000 में से एक किरण सोने की पन्नी से टकराकर 180 के कोण से वापस आ गई।4. रदरफोर्ड की परमाणु संस्चना को समझास्से-
उत्तर -रदरफोर्ड ने अपनी स्वय की परमाणु संरचना को प्रस्तावित किया। जो अधो लिखित है।
1. नामिक एक परमाणु के केन्द्र में होता है। जहाँ अधिकांश आवेश और द्रव्यमान होता हैं |
2. परमाणु संरचना गोलाकार होती है।
३. जिस तरह से यह सूर्य की परिक्रमा करते है इलेक्ट्रान एक गोलाकार कक्षा में नामिक के चारों और घूमते है।
रदरफोर्ड के मौडल की कमियां –
1. यदि इलेक्ट्रान को नामिक के चारों ओर धूमता है, तो वह ऊर्जा खर्च करेगे, और वो भी नामिक से आर्कषण वल के विरुद्ध, इनेण की बहुत सारी ऊर्जा समाप्त हो जायेगी, और अंत में सब ऊर्जा खो देंगे और गिर जायेंगे। अतः रदर फोर्ड परमाणु के स्टबेलिटी की व्यखाया नई कर सका |
2. यदि इलेक्ट्रान लगातार नाभिक’ के चारो ओर धूमते है, तो अपेक्षित स्पेक्ट्रम का प्रकार एक सतत स्पेक्ट्रम होता है जो गलत हैं |
बोहर का परमाणु सिद्धान्त को समझाइये
उत्तर -नील बोहर ने वर्ष 1915 में परमाणु के अपने माडल को सामने रखा था। आज भी यह तत्त्व की व्यापक व्याख्या करने के लिए इस्तेमाल करते हैं। यह परमाणु प्लाक के परिमाणी करण के सिद्धान्त पर आधारित है।.परमाणुओं के अंदर इलेक्ट्रानो को असतत कक्षाओं में रखा जाता है, जिन्हें स्थिर कक्षा कहा जाता है।
1. इन कोशो के ऊर्जा स्तरों को क्वाटम सख्याओं द्वारा प्रदर्शित किया जाता है।
2. जब तक एक इलेक्ट्रान अपने स्थिर क्षेत्र में रहता है तो ऊर्जा का कोई अवशोषण या उत्सर्जन नहीं करता है।
3. इलेक्ट्रान इन स्थिर कक्षाओ मे ही नाभिक के चारो ओर घूमते हैं।
4. स्थिर कक्षाओ की ऊर्जा परिमाणित होती है।
बोहर के परमाणु सिद्धान्त की सीमाएँ
बोहर के परमाणु सिद्धान्त की सीमाएँ
1.बोहर की परमाणु संस्चना केवल एकल इलेक्ट्रान प्रजाति के लिए काम करती है .
EXAMPLE -H. He, Liz, Bez
2.जब अधिक सटीक स्पेक्ट्रोमीटर के तहत H₂ के उत्सर्जन स्पेक्ट्रम को देखा गया,
3.बोहर के सिद्धान्त का उपयोग करके स्टार्क व जीमेन दोनो प्रभावो की व्याख्या नही की जा सकती है।
हाइजेनवर्ग का अनिश्चिता सिद्वान्त को समझाइये ?
उत्तर -इलेक्ट्रान कण व तरंग दोनों की प्रकृति करती पायी जाती है। तथा किसी तरंग की वास्तविक स्थिति को नहीं बता सकते है,
1-यदि तरंग की वास्तविक स्थिति को 100%, बतायेगे तो तरंग के मान में सही तथा कण मे अन्तर मा जायेगा
2-जर्मन भौतिक विज्ञानी वर्नर हाइजेनबर्ग ने इसी सिद्धान्त को दिया।
अतः ” किसी सूदुम कण की स्थिति व संवेग का एक साथ सही-2 निर्धारण करना असम्भव है|
गणितीय रूप मे